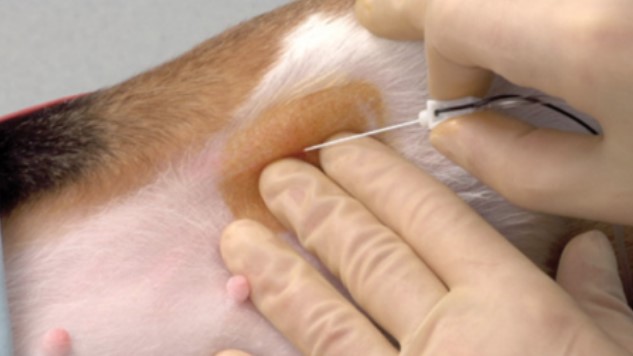
Anesthésie loco-régionale Utilisation d’un neurostimulateurpour des blocs nerveux
Référence de l’article : Contentin R, Jammes M, Bourdon B, Cassé F, Bianchi A, Audigié F, Branly T, Velot É, Galéra P. Bone Marrow MSC Secretome Increases Equine Articular Chondrocyte Collagen Accumulation and Their Migratory Capacities. Int J Mol Sci. 2022 May 21;23(10):5795. doi: 10.3390/ijms23105795. PMID: 35628604; PMCID: PMC9146805
Principes de la neurostimulation :
Les neurostimulateurs sont utilisés en médecine humaine depuis les années 1970. Ils gagnent en popularité au sein de la médecine vétérinaire depuis le début des années 2000. Le neurostimulateur était d’abord utilisé pour la recherche en neurophysiologie et l’intérêt pour la localisation de nerfs d’intérêt a suivi pour l’anesthésie loco-régionale. Le neurostimulateur permet de générer un champ électrique au sein de tissus qui entoure immédiatement un nerf. Si ce nerf contient des fibres motrices, le courant électrique induit une dépolarisation de ces nerfs et par conséquent la contraction des muscles pour lesquels il est moteur. Ces contractions permettent d’identifier la localisation du nerf et le placement correct de l’aiguille stimulatrice. Le phénomène repose sur l’électrophysiologie. La cathode (électrode généralement noire sur le neurostimulateur), provoque la dépolarisation de l’axone. L’anode (électrode rouge), provoque son hyperpolarisation. Cela explique pourquoi l’électrode négative (cathode), est connectée à l’aiguille stimulatrice puisque c’est elle qui stimule le nerf et donc la contraction musculaire.

Neurostimulateur et aiguille stimulatrice (BBRAUN, Stimuplex® A)
Rappelons que chaque nerf possède ses particularités électrophysiologiques en fonction de sa taille et de son type de fibre. Les fibres de grand diamètre sont plus aisément stimulables que les fibres de petit diamètre : c’est pourquoi les nerfs moteurs sont stimulables à plus faible intensité que les nerfs sensitifs. La loi de Coulomb relie la distance à laquelle une électrode va stimuler un nerf : plus l’aiguille stimulatrice est proche du nerf, plus faible sera l’intensité nécessaire pour atteindre une réponse motrice. Rappelons aussi ici que la résistance des tissus et leur conductivité est variable, et la réponse motrice d’un nerf peut varier en fonction des tissus rencontrés par l’aiguille stimulatrice.
L’impulsion électrique d’un neurostimulateur est une vague électrique de durée, intensité et voltage connue. En général, on choisit une durée de 100µs, une intensité de 1mA et un voltage de 1V. La fréquence du stimulus pour aussi être choisit pour certains neurostimulateurs, on utilise 1 à 2Hz. Les fibres motrices sont stimulées sur des durées de stimulation inférieure à 0,2ms. Les fibres sensitives (Aδ et C) sont dépolarisées pour une durée d’impulsion supérieure. C’est pourquoi on choisit préférentiellement des durées de 0,05 à 0,1ms pour stimuler préférentiellement les fibres motrices de gros diamètre (Aα). Pour le confort du patient, l’insertion de l’aiguille et les contractions musculaires induites par le courant électrique nécessite une sédation profonde ou une anesthésie générale.
En pratique : comment ça marche ?
Pour un vétérinaire qui réalise un geste provoquant une douleur nociceptive, le concept d’analgésie multimodale est essentiel. L’anesthésie loco-régionale s’inscrit dans cette idée. La neurostimulation permet la localisation de nombreux territoires et le dépôt d’un anesthésique local au plus prêt du nerf concerné. Plusieurs types d’anesthésiques locaux peuvent être utilisés. On choisira chaque traitement pour la durée souhaité du bloc nerveux. Il est aussi fondamental de connaître l’anatomie de la région que l’on souhaite anesthésier pour plusieurs raisons : afin d’éviter la ponction d’organe ou de vaisseaux nobles et afin d’identifier le nerf réellement visé. Pour donner un exemple, citons le bloc nerveux du nerf fémoral en approche inguinale décrite par Luis Campoy (2006). Le site d’intérêt est le triangle fémoral, délimité crânialement par le muscle sartorius, caudalement par le pectiné et proximalement par l’ilio-psoas. Il est fondamental d’identifier à la palpation l’artère fémorale pour éviter sa ponction. La ponction est réalisée avec un angle de 30° environ en direction de l’ilio-psoas, crânialement à l’artère fémorale. Le neurostimulateur délivre une intensité de 1mA.
La stimulation du nerf fémoral va générer la contraction des muscles pour lesquels il est moteur. On observera entre autre une contraction du quadriceps qui va fléchir le genou de l’animal. On réduira ensuite l’intensité du courant délivré jusqu’à 0,2mA pour s’assurer qu’aucune contraction ne persiste. Si tel est le cas, l’injection intraneurale est possible et des lésions nerveuses peuvent être conséquentes. Une aspiration négative de la solution à injecter est réalisée pour éviter toute injection intra-vasculaire d’un anesthésique local potentiellement cardiotoxique. Le courant est alors remonté à 0,4mA et l’anesthésique est injecté tout en s’assurant qu’aucune résistance ne soit ressentie.
Conclusion
L’utilisation de neurostimulateurs pour la réalisation d’anesthésie loco-régionale est de plus en plus répandue. Elle requiert la connaissance précise de l’anatomie et du rôle (moteurs et sensitifs) des nerfs visés. De plus, elle ne nécessite pas de matériel onéreux. Enfin, lorsqu’elle est efficace, l’anesthésie loco-régionale permet la diminution des médicaments utilisés par voie systémique qui peuvent présenter des effets secondaires.
Aujourd’hui, les anesthésistes vétérinaires associent régulièrement l’utilisation de la neurostimulation à l’identification échoguidés des structures nerveuses. Les neurostimulateurs seuls trouvent leur place pour de nouveaux objectifs comme la réalisation de blocs nerveux pour les rachi-anesthésies ou chez les nouveaux animaux de compagnie.
Raphaëlle Laffitte, DVM, résidente ECVAA (European College of Veterinary Anesthesia and Analgesia)
* D’après les différentes éditions de Small Animal Regional Anesthesia and Analgesia, par Luis Campoy et Matt Read et la 2ème édition de Manual of Small Animal Regional Anesthesia, par Pablo Otero et Diego Portela.