Cathéter intra Osseux chez l’oiseau
La mise en place de perfusion continue et fortement indiquée chez les oiseaux souffrant de douleurs sévères ou chroniques. Lorsque la mise en place d’un cathéter intraveineux échoue ou lorsque les veines sont trop petites ou fragiles, un cathéter intra-osseux (IO) est une excellente option pour les oiseaux. Quasiment toutes les molécules pouvant être injectées par voie intraveineuse (à l’exception des agents de chimiothérapie par exemple) peuvent être injectées par voie intra osseuse. Cette voie d’administration permet une diffusion tout aussi rapide et tout aussi efficace que la voie intra veineuse. Elle est réalisable quel que soit la taille de l’animal. Le diamètre de l’aiguille utilisée sera cependant à ajuster. Les sites de pose de cathéter intra osseux sont le tibiotarse proximal et l’ulna distal. Seule cette dernière technique sera développée dans cette fiche.
Matériel nécessaire :
- Choisissez une aiguille hypodermique ou spinale d’un calibre de 18 (oie de 10 Kg) à 25 G (perruche ondulée de 50g), suffisamment longues pour couvrir un tiers à la moitié de la longueur de la cavité médullaire.
- Gants
- Compresses imbibées de chlorhexidine savon et solution
- Porte aiguille, pince, ciseau, fil de suture
- Seringue de 1 mL remplie de NaCl ou Ringer Lactate pour flusher
- Bouchon de cathéter
- Ruban adhésive médical
- Bande autoadhésive
En fonction de l’état clinique de l’animal et de son tempérament, celui-ci peut être anesthésié (anesthésie flash isoflurane/sevoflurane), sédaté (midazolam), ou vigile (chez les animaux en état de choc par exemple). Avant de réaliser cette procédure l’animal devra recevoir une première injection d’analgésique (butorphanol, fentanyl en fonction des espèces) qui servira de bolus pour la perfusion continue, et d’analgésie pour cette procédure.
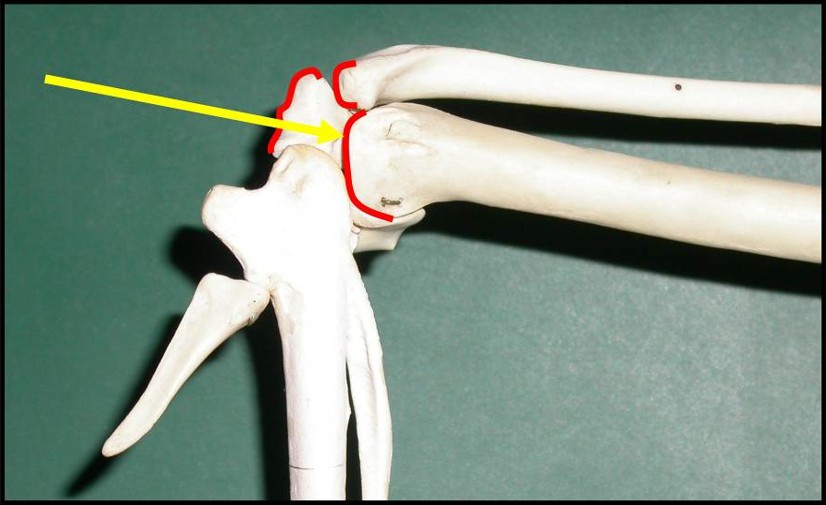
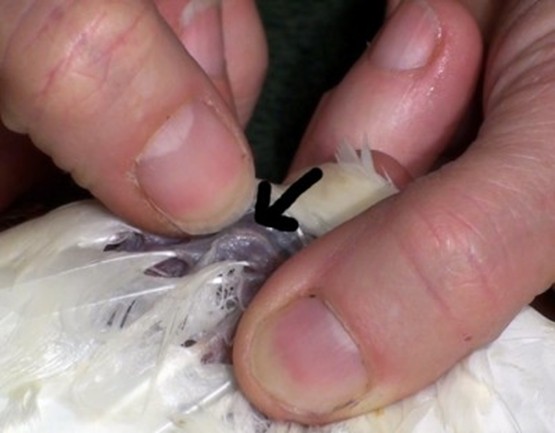
L’animal est positionné en décubitus sternal (photo 1A). La zone en regard du poignet est plumée suffisamment large afin qu’en aucun cas le site du cathéter ne vienne frotter avec les plumes. Afin de prendre ses repères anatomiques, le poignet est fléchi à 90° ce qui permet d’avoir accès à l’ulna (photo 1B).
La zone plumée est préparée aseptiquement avec trois lavages, en utilisant des compresses imbibées de chlorhexidine savon et solution. Cette étape doit être réalisée rigoureusement afin d’éviter toute inoculation de germe dans le la médulla osseuse.
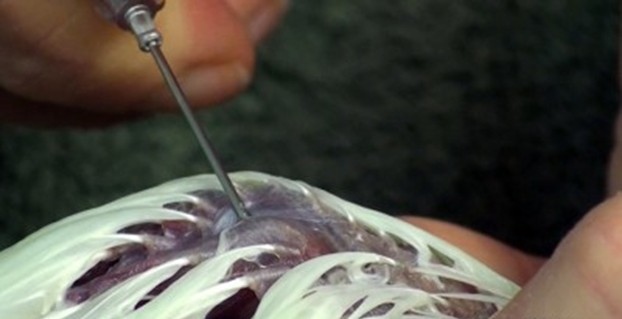
L’articulation du poignet toujours maintenue dans une position avec 90° de flexion, l’aiguille hypodermique qui servira de cathéter intra osseux est insérée à travers la peau. Lorsque la pointe de l’aiguille butte sur la tête de l’ulna, il est important de vérifier que l’axe de l’aiguille est parfaitement orienté dans l’axe de l’ulna.
Avec l’index et le pouce, une pression toute en réalisant une rotation est appliquée afin de traverser la corticale du plateau tibial. Cette procédure doit se faire tout en maintenant l’axe de l’aiguille dans l’axe du tibia. Cette étape peut nécessiter un peu de force, notamment chez les grands lapins. Une fois la corticale traversée, l’aiguille ne rencontre plus de résistance et va glisser avec une très faible pression exercée. Enfoncer l’aiguille jusqu’à la garde et positionner le bouchon de cathéter.
Afin de vérifier le bon placement du cathéter, toujours aiguille enfoncée, celui-ci est mobilisé les doigts de l’utilisateur positionnés autour du tibia. Si la pointe de l’aiguille est sentie lors de cette mobilisation alors le cathéter est ressorti de la médulla osseuse et doit être repositionnée. Lors de doute, une radiographie de contrôle peut être réalisée. A l’aide de la seringue de 1 mL remplie de NaCl ou de Ringer Lactate, flusher le cathéter intra-osseux tout en maintenant ses doigts autour du tibia. Il ne faut pas sentir de gonflement autour du tibia. Il peut arriver qu’une carotte osseuse bloque l’intérieur de l’aiguille et empêche l’injection de fluide dans le cathéter. Dans ce cas, prenez une nouvelle aiguille afin de remplacer celle bloquée. Une fois le trou dans la corticale de plateau tibial fait, il est quasi automatique de repasser directement par ce même trou.
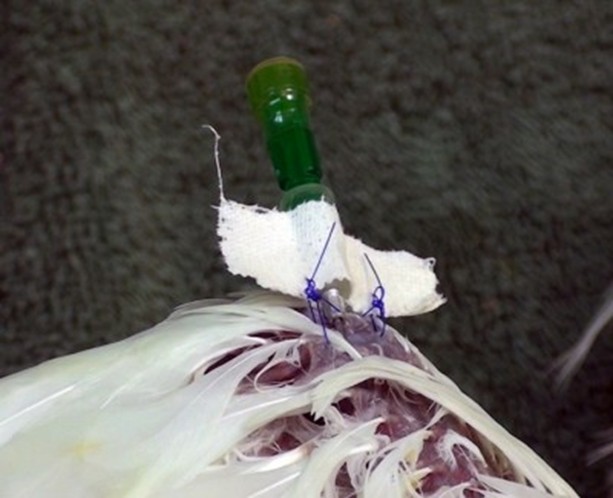
Afin de maintenir le cathéter en place, un ruban adhésif sera positionné entourant le cathéter et le membre de l’animal. Celui-ci peut ensuite être protégé par une bande autoadhésive.
Au cours de son utilisation, il est important de vérifier bi-quotidiennement qu’il n’y a pas de présence de souillure, de gonflement, de douleur, de chaleur au niveau du membre et que le patient ne présente pas d’hyperthermie. Dans le cas contraire, les sparadraps devront être retirés afin d’inspecter le site du cathéter et en fonction de résultats de cette inspection visuelle le cathéter devra être retiré.
Complications potentielles
Les complications secondaires à la pose d’un cathéter IO sont rares. Une petite extravasation de fluide peut survenir et considérée comme acceptable. Dans de rares cas, une infection ou des embolies de graisse ou de moelle osseuse peuvent se développer.
Références
Hawkins MG, Graham JE. Emergency and critical care of rodents. Vet Clin North America Exotic Animal Practice 10(2):516, 2007.
Hasan MY, Kissoon N, Khan TM, et al. Intraosseous infusion and pulmonary fat embolism. Pediatr Crit Care Med 2(2):133–138, 2001.
Mahajan R, Nazir R, Mehta S. An overview of intraosseous access. Anesth Analg 111(3): 825-826, 2010.
Paul-Murphy J. Critical care of the rabbit. Vet Clin North America Exotic Animal Practice 10(2):440, 2007.
Schwartz T, Störk CK, Megahy IW, et al. Osteodystrophia fibrosa in two guinea pigs. J Am Vet Med Assoc 219(1):63-66, 2001.
Zehnder A. Intraosseous catheter placement in small mammals. Lab Anim 37(8):351-352, 2008.
Découvrir plus d'articles

Une avancée prometteuse dans le traitement du statut épileptique réfractaire chez les chiens
Lire plus »